A Química Orgânica recebeu inicialmente esse nome para descrever substâncias extraídas de organismos vivos. Acreditava-se que elas só podiam ser produzidas em organismos vegetais e animais, mas nunca em laboratório.
Entretanto, provou-se que o homem
conseguia sim sintetizar compostos orgânicos em laboratório, e então a
definição de Química Orgânica mudou para:
“Ramo da Química que estuda a maioria dos compostos formados pelo elemento carbono”.
Visto que o carbono é tetravalente,
podendo realizar quatro ligações de diferentes maneiras, com átomos de
outros elementos ou com átomos do próprio carbono, existem milhões de
seus compostos. Uma quantidade muito superior do que a de compostos
inorgânicos conhecidos atualmente.
Foi o início do uso de medicamentos para curar as enfermidades da época (séculos XVI e XVII).
Somente no século XVIII foram extraídas várias substâncias a partir de produtos naturais, além daquelas anteriormente conhecidas (vinho, fermentação da uva e os produtos obtidos pela destilação de várias outras substâncias).
Neste mesmo século - no ano de 1777-, a química foi dividida em duas partes de acordo com Torben Olof Bergmann:
- a Química Orgânica que estudava os compostos obtidos diretamente dos seres vivos e
- a Química Inorgânica que estudava os compostos de origem mineral.
Entretanto, o desenvolvimento da Química Orgânica era prejudicado pela crença de que, somente a partir dos organismo vivos - animais e vegetais - era possível extrair substâncias orgânicas. Tratava-se de uma teoria, conhecida pelo nome de "Teoria da Força Vital", formulada por Jöns Jacob Berzelius, que afirmava: a força vital é inerente da célula viva e o homem não poderá criá-la em laboratório."
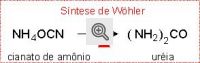
Em 1828, após várias tentativas, um dos discipulos de Berzelius, mais precisamente Friedrich Wöhler, conseguiu por acaso obter uma substância encontrada na urina e no sangue, conhecida pelo nome de uréia.
Estando no laboratório, Wöhler aqueceu o composto mineral "cianato de amônio" e obteve a "uréia", composto orgânico, derrubando assim, a Teoria da Força Vital.
 Após
o êxito desta experiência vários cientistas voltaram ao laboratório
para obter outras substâncias orgânicas e verificaram que o elemento
fundamental era o carbono.
Após
o êxito desta experiência vários cientistas voltaram ao laboratório
para obter outras substâncias orgânicas e verificaram que o elemento
fundamental era o carbono.
Em 1858 Friedrich A. Kekulé definiu a Química Orgânica como sendo a parte da química dos compostos do carbono.
Atualmente são conhecidos milhões de compostos orgânicos e diarimente, devido às pesquisas para a obtenção de novas substâncias, o número de compostos orgânicos aumenta consideravelmente.
Os alquimistas, como eram chamados os primeiros pesquisadores tinham por objetivos:
- transformar qualquer metal em ouro - princípio chamado de "pedra filosofal" e
- o "elixir da vida", para prolongar a vida.
O
médico Paracelso (Suiço) que também atuava no campo da alquimia,
afirmou, que "o homem é um composto químico, cujas doenças são
decorrrentes das alterações desta estrutura, sendo necessários
medicamentos para combater as enfermidades." - transformar qualquer metal em ouro - princípio chamado de "pedra filosofal" e
- o "elixir da vida", para prolongar a vida.
Foi o início do uso de medicamentos para curar as enfermidades da época (séculos XVI e XVII).
Somente no século XVIII foram extraídas várias substâncias a partir de produtos naturais, além daquelas anteriormente conhecidas (vinho, fermentação da uva e os produtos obtidos pela destilação de várias outras substâncias).
Neste mesmo século - no ano de 1777-, a química foi dividida em duas partes de acordo com Torben Olof Bergmann:
- a Química Orgânica que estudava os compostos obtidos diretamente dos seres vivos e
- a Química Inorgânica que estudava os compostos de origem mineral.
Entretanto, o desenvolvimento da Química Orgânica era prejudicado pela crença de que, somente a partir dos organismo vivos - animais e vegetais - era possível extrair substâncias orgânicas. Tratava-se de uma teoria, conhecida pelo nome de "Teoria da Força Vital", formulada por Jöns Jacob Berzelius, que afirmava: a força vital é inerente da célula viva e o homem não poderá criá-la em laboratório."
Em 1828, após várias tentativas, um dos discipulos de Berzelius, mais precisamente Friedrich Wöhler, conseguiu por acaso obter uma substância encontrada na urina e no sangue, conhecida pelo nome de uréia.
Estando no laboratório, Wöhler aqueceu o composto mineral "cianato de amônio" e obteve a "uréia", composto orgânico, derrubando assim, a Teoria da Força Vital.
 Após
o êxito desta experiência vários cientistas voltaram ao laboratório
para obter outras substâncias orgânicas e verificaram que o elemento
fundamental era o carbono.
Após
o êxito desta experiência vários cientistas voltaram ao laboratório
para obter outras substâncias orgânicas e verificaram que o elemento
fundamental era o carbono. Em 1858 Friedrich A. Kekulé definiu a Química Orgânica como sendo a parte da química dos compostos do carbono.
Atualmente são conhecidos milhões de compostos orgânicos e diarimente, devido às pesquisas para a obtenção de novas substâncias, o número de compostos orgânicos aumenta consideravelmente.
fontes :http://mundoeducacao.bol.uol.com.br/quimica/quimica-organica.htm
https://www.algosobre.com.br/quimica/historia-da-quimica-organica.html
http://pt.depositphotos.com/41032625/stock-photo-organic-chemistry.html





















